Diferencia entre la saponificación y la neutralización
 Share
Share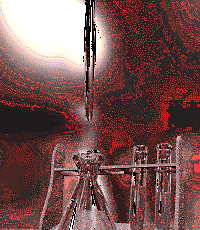
Diferencia Principal - Saponificación vs Neutralización
La saponificación y la neutralización son reacciones químicas muy importantes que se utilizan tanto a escala de laboratorio como a escala industrial. La saponificación es generalmente la formación de jabón en forma de suspensión. Esto ocurre debido a la escisión de un triglicérido en glicerol y ácidos grasos. La neutralización es la formación de un medio neutro después de que haya tenido lugar una reacción química. Esto se puede observar principalmente en reacciones ácido-base. Los ácidos son capaces de liberar H+ Los iones y las bases son capaces de liberar OH- iones. Cuando todo h+ Los iones liberados del ácido reaccionan con todo OH- Los iones liberados por la base, se dice que el medio ha sido neutralizado. La principal diferencia entre la saponificación y la neutralización es que La saponificación incluye la escisión de un éster en alcohol e ión carboxilato, mientras que la neutralización incluye la formación de un medio neutro después de la reacción química..
Áreas clave cubiertas
1. ¿Qué es la saponificación?
- Definición, Mecanismo, Extracción
2. ¿Qué es la neutralización?
- Definición, diferentes tipos
3. ¿Cuál es la diferencia entre la saponificación y la neutralización?
- Comparación de diferencias clave
Términos clave: Básico, ácido carboxílico, éster, exotérmico, ácidos grasos, glicerol, hidróxido de potasio, saponificación, jabón, triglicéridos

¿Qué es la saponificación?
La saponificación es un proceso mediante el cual los triglicéridos reaccionan con el hidróxido de sodio o potasio para producir glicerol y una sal de ácido graso llamada "jabón". La saponificación incluye la escisión de un éster en ácido carboxílico y alcohol usando NaOH o KOH en presencia de agua. Aquí, debido a la basicidad del medio, se produce ion carboxilato en lugar de ácido carboxílico..
Un triglicérido es un éster que se deriva de la reacción entre un glicerol y ácidos grasos. Aquí, una molécula de glicerol se combina con tres moléculas de ácidos grasos. Cada ácido graso tiene un grupo ácido carboxílico. Molécula de glicerol tiene tres grupos hidroxilo (-OH). Por lo tanto, tres ácidos grasos pueden combinarse con estos tres grupos hidroxilo que forman el éster. En la saponificación, tres ácidos grasos se separan del glicerol..
El mecanismo de saponificación incluye los siguientes pasos:
- Ataque de nucleófilos
- Dejando la eliminación de grupo
- Desprotonacion

Figura 1: Mecanismo de saponificación.
En general, la reacción química entre cualquier grasa y NaOH es la saponificación. La reacción es exotérmica, en la que se libera calor al entorno. Cuando el jabón se forma a través de la saponificación, permanece como una suspensión. Luego, el jabón se puede separar a través de salazón (formación de jabón sólido a partir de la suspensión agregando sal común a la suspensión).
¿Qué es la neutralización?
Una reacción de neutralización es una reacción química entre un ácido y una base que produce una solución neutra. Una solución neutra siempre tendrá el pH 7. Esta reacción implica la combinación de H+ iones y oh- Iones para formar moléculas de agua..
Si el pH final de una mezcla de reacción ácida y básica es 7, eso significa cantidades iguales de H+ y oh- Los iones han reaccionado aquí (para formar una molécula de agua, una H+ ion y un OH- se requieren iones). Los ácidos y bases reaccionados pueden ser fuertes o débiles. Las reacciones varían dependiendo de este hecho..
Neutralización fuerte fuerte ácido-fuerte
- Los ácidos fuertes y las bases fuertes se disocian completamente en iones en medio acuoso. De ahí que liberen todos los posibles H.+ y oh- iones en el medio.
Neutralización débil de la base ácido-débil
- Este tipo de reacción no da una neutralización completa porque los ácidos débiles y las bases débiles no se disocian completamente en sus iones. Por lo tanto, un ácido débil no puede ser neutralizado por una base débil y viceversa.
Neutralización de bases débiles ácido-fuertes
- La neutralización de un ácido débil con una base fuerte le da al medio un pH mayor que 7.
Neutralización fuerte fuerte ácido-débil
- La neutralización de un ácido fuerte con una base débil da como resultado un pH bajo de 7.
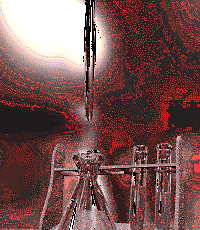
Figura 2: Realización de una reacción ácido-base
Diferencia entre la saponificación y la neutralización
Definición
Saponificación: La saponificación es un proceso mediante el cual los triglicéridos reaccionan con el hidróxido de sodio o potasio para producir glicerol y una sal de ácido graso llamada "jabón"..
Neutralización: Una reacción de neutralización es una reacción química entre un ácido y una base que produce una solución neutra (pH = 7).
Principio
Saponificación: La saponificación incluye la escisión de un éster en alcohol e ión carboxilato.
Neutralización: La neutralización incluye la formación de un medio neutro después de la reacción química..
Productos finales
Saponificación: La saponificación da glicerol y una sal de ácido graso (jabón).
Neutralización: La neutralización da sal y agua..
Reacción química
Saponificación: La saponificación incluye la reacción entre un éster e hidróxido de sodio o potasio en presencia de agua..
Neutralización: La neutralización incluye la reacción entre un ácido (fuerte o débil) y una base (fuerte o débil).
Resultado final
Saponificación: La saponificación forma el jabón como una suspensión que se puede separar a través de salazón sin jabón..
Neutralización: La neutralización forma un medio con pH 7..
Conclusión
La saponificación es básicamente la formación de jabón. Esto implica la escisión de un éster en alcohol y ácido carboxílico (en un medio básico, se forma el ion carboxilato). La neutralización, por otro lado, es la formación de un medio neutro después de la reacción entre un ácido y una base. La principal diferencia entre la saponificación y la neutralización es que la saponificación incluye la escisión de un éster en alcohol e ión carboxilato mientras que la neutralización incluye la formación de un medio neutro después de la reacción química.
Referencia:
1. Helmenstine, Anne Marie. “Definición y reacción de la saponificación”. ThoughtCo, 3 de octubre de 2017, disponible aquí.
2. Libretextos. "Saponification". Chemistry LibreTexts, Libretexts, 21 de julio de 2016, disponible aquí.
3. Helmenstine, Anne Marie. “Definición de neutralización”. ThoughtCo, 26 de abril de 2016, disponible aquí.
Imagen de cortesía:
1. “Wikipedia ester hydrolysis”. Por Chem540grp5f08 - Trabajo propio (Dominio público) a través de Commons Wikimedia.
2. "Titulación" Por Jfreyre ~ commonswiki asumió - trabajo propio asumido (basado en reclamaciones de derechos de autor) (CC BY-SA 2.5) a través de Commons Wikimedia
